 北交所IPO审核问答30条全文公开!负面行业清单出炉!
北交所IPO审核问答30条全文公开!负面行业清单出炉!
发布日期:2022-05-16浏览次数:2560
 高粮价预警:用不起化肥,全球水稻产量将减产10%
高粮价预警:用不起化肥,全球水稻产量将减产10%
发布日期:2022-04-21浏览次数:2245
 中小企业经营调查:多地出台“纾困”计划,期待打通物流“堵点”
中小企业经营调查:多地出台“纾困”计划,期待打通物流“堵点”
发布日期:2022-04-21浏览次数:2202
 人民币中间价连续两日下调 不存在长期贬值的基础
人民币中间价连续两日下调 不存在长期贬值的基础
发布日期:2022-04-21浏览次数:2154
发布日期:2022-11-22浏览次数:1168
发布日期:2022-12-06浏览次数:1015
发布日期:2022-05-13浏览次数:968
发布日期:2022-08-25浏览次数:964
发布日期:2022-12-01浏览次数:922
发布日期:2022-05-13浏览次数:921
前次 IPO 现场检查问题的整改!
问题 20.关于前次 IPO 现场检查问题的整改
根据保荐工作报告,发行人曾于 2012 年 12 月 21 日申报创业板上市,2015年 4 月 3 日被抽中现场检查,经检查发现的财务问题包括:
(1)2013 年度销售费推广费预提不足导致部分销售费用跨期确认的问题;
(2)部分销售签收单未签署日期或者签收单未及时收回导致收入确认时点的问题;
(3)存在部分员工釆用个人账户或现金收款的问题。针对上述现场检查问题,发行人进行了整改。
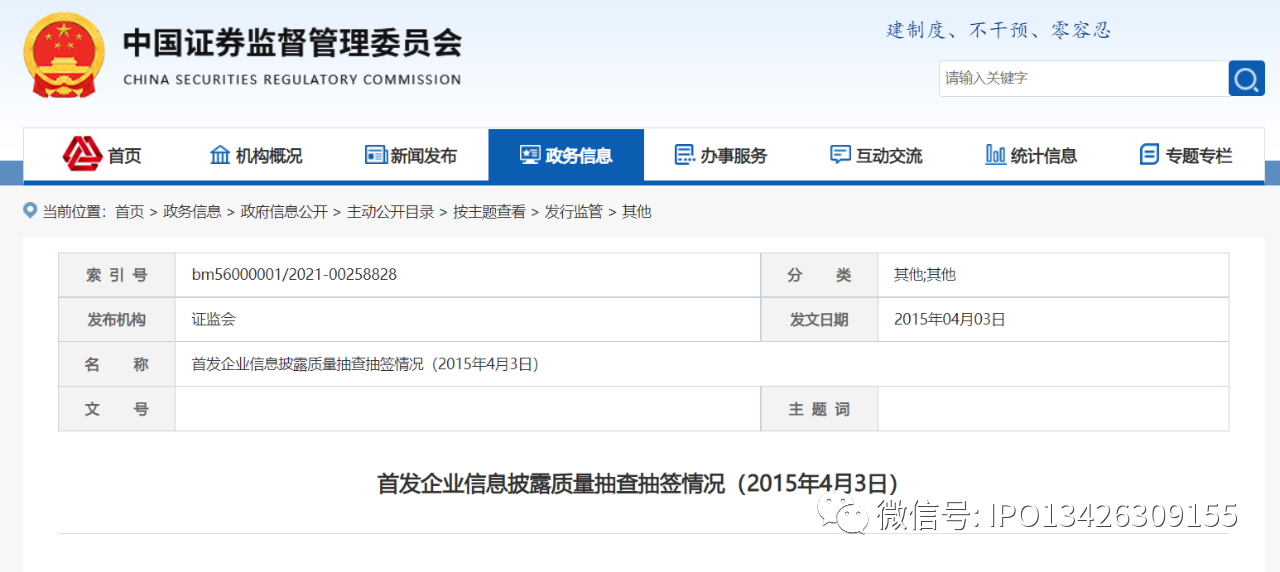
首发企业信息披露质量抽查抽签情况(2015年4月3日)
根据《关于组织对首发企业信息披露质量进行抽查的通知》(以下简称《通知》)(发行监管函[2014]147号)要求,中国证券业协会于2015年4月3日组织完成了对首发企业信息披露质量抽查的抽签工作。本批参与抽签企业共80家,其中被抽到企业为新丽传媒股份有限公司、上海康德莱企业发展集团股份有限公司、山东博润工业技术股份有限公司、四川百利天恒药业股份有限公司。中国证监会将按照《通知》的要求,对新丽传媒股份有限公司、上海康德莱企业发展集团股份有限公司、山东博润工业技术股份有限公司、四川百利天恒药业股份有限公司信息披露质量及中介机构执业质量进行检查。
发行监管部
2015年4月3日

发行人名称:四川百利天恒药业股份有限公司
成立日期:2006 年 8 月 17 日
注册资本:36,090.00 万元
法定代表人:朱义
注册地址及主要生产经营地址:成都市温江区成都海峡两岸科技产业园百利路 161 号一幢一号
控股股东及实际控制人:朱义
行业分类:医药制造业(C27)
发行人主营业务概况和未来发展战略
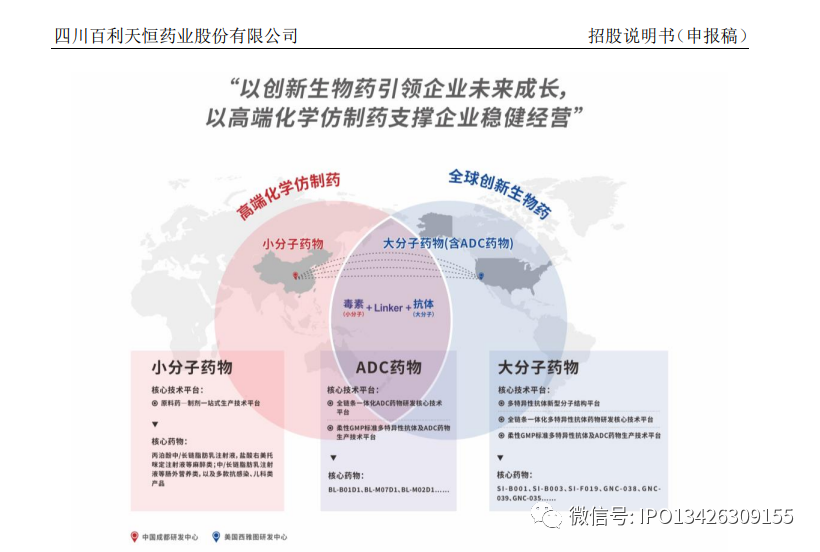
发行人是一家集药品研发、生产与营销一体化的现代生物医药企业,拥有化
药制剂与中成药制剂业务板块和创新生物药业务板块,具备包括小分子化学药、大分子生物药及抗体偶联药物(ADC 药物)的全系列药物研究开发生产能力;拥有中美两地研发中心(美国:Systimmune;中国:百利药业和多特生物等)、1 个大分子生物药及抗体偶联药物(ADC 药物)生产企业(多特生物)、2 个化药制剂生产企业(百利药业和国瑞药业)、1 个化学原料药生产企业(精西药业)、1 个化学中间体生产企业(海亚特科技)以及 2 个药品营销公司(百利天恒和拉萨新博);覆盖从中间体、原料药到制剂的上下游一体化能力及“研发—生产—营销”完整全生命周期商业化运营能力。
发行人坚持“让每个人因为健康而对百利充满信任和期待”的愿景,持续进行高端化学仿制药产品的开发以及全球创新的生物药技术平台和产品的研发。与常见的生物科技型企业不同,发行人以化学仿制药和中成药起步,经过 25年的发展,已建立了完整的制药企业研产供销体系,有着较为稳定的收入。公司发挥自身在化学药物领域的研发优势及“原料药—制剂一站式生产技术平台”的优势,致力于支持和配合国家药物集采战略,努力为患者提供安全、有效、可负担的优质药物,以满足亟待解决的治疗需求。经过多年的技术积累和业务发展,发行人已掌握脂肪乳注射剂、大/小容量注射剂、冻干粉针剂、口服固体制剂等多剂型生产能力,储备有丰富的产品和在研管线,涵盖麻醉、肠外营养、抗感染、儿科等临床亟需领域。截至报告期末,公司拥有化学制剂注册批件 179 个(其中涉及 2 个独家制剂品种),原料药注册批件 11 个。公司围绕现有产品重点治疗领域,积极进行产品布局,拥有丰富化学药产品储备,具备较强的产品的迭代能力。截至本招股说明书签署日,公司重点化学药在研项目 26 个(其中申报上市阶段 6 个),特别在儿科领域,作为中国儿童药物研发和产业化联盟首批成员单位,公司积极响应国家鼓励儿童用药研发申报的政策,借助自身原料药及特殊制剂制造技术,承担了国家级项目儿童药专用技术开发和产业化能力建设-原料药及颗粒剂等多种制剂技术平台的建设任务,以及五个与儿童药相关的重大新药创制项目。目前儿童药在研项目 8 个,其中马来酸依那普利口服溶液(第三批鼓励清单,重大新药创制项目)已申请上市并完成了现场检查,盐酸胍法辛原料及缓释片(第二批鼓励清单,重大新药创制项目)已申请上市。
公司经过长期的行业和市场积累,逐步建立起良好的口碑和市场影响力,组建了完善的销售团队和销售体系,营销网络遍布全国 30 多个省、200 余个地级市,实现了对不同地域的覆盖,以及“高—中—低”多层级市场的全面渗透。与传统的化学仿制药企业不同,发行人长期聚焦于全球生物医药前沿领域的研究探索,基于科学原理和科学逻辑,以临床需求为导向,坚持自主创新和原研技术积累,致力于创建具有全球知识产权和全球权益的创新生物药研发平台。基于平台技术,公司可随着新靶点、新药理机制及具有潜在成药性分子的不断发现,源源不断的推出候选创新生物药进入临床前和临床研究。经过 10 年的积累,公司创新生物药板块已经颇具规模,且有着具备全球竞争力的阶段性成果。现已形成“多特异性抗体新型分子结构平台”、“全链条一体化多特异性抗体药物研发核心技术平台”、“柔性 GMP 标准多特异性抗体及 ADC 药物生产技术平台”等核心技术平台,并基于前述平台开发出具有突破性疗效、具备全球竞争力的成系列产品。截至本招股说明书签署日,发行人共有 9 个双/多特异性抗体及融合蛋白药物在研项目。其中治疗非小细胞肺癌等上皮肿瘤的双特异性抗体 SI-B001已进入 II 期临床试验,是全球范围内基于 HER3 靶点进展最快的双特异性抗体药物;治疗 COVID-19 新冠病毒的融合蛋白药物 SI-F019,已完成 I 期临床研究,即将进入 II 期临床,其对突变的病毒株拥有潜在的治疗和预防作用。四特异性抗体 GNC-038、GNC-039、GNC-035 已进入I 期临床试验,是全球前 3 个进入临床研究阶段的四特异性抗体,未来拟探索多种恶性肿瘤的治疗,全球其他企业都尚处于早期的临床前探索阶段。进入 I 期临床试验的双抗 ADC 药物BL-B01D1 是全球第三个,中国首个进入临床研究阶段的靶向双靶点的双抗 ADC 候选药物。
发行人选择的具体上市标准
(一)发行人选择的上市标准情况
公司符合并适用《上海证券交易所科创板股票上市规则》第 2.1.2 条第(四项规定的上市标准:预计市值不低于人民币 30亿元,且最近一年营业收入不于人民币 3 亿元。
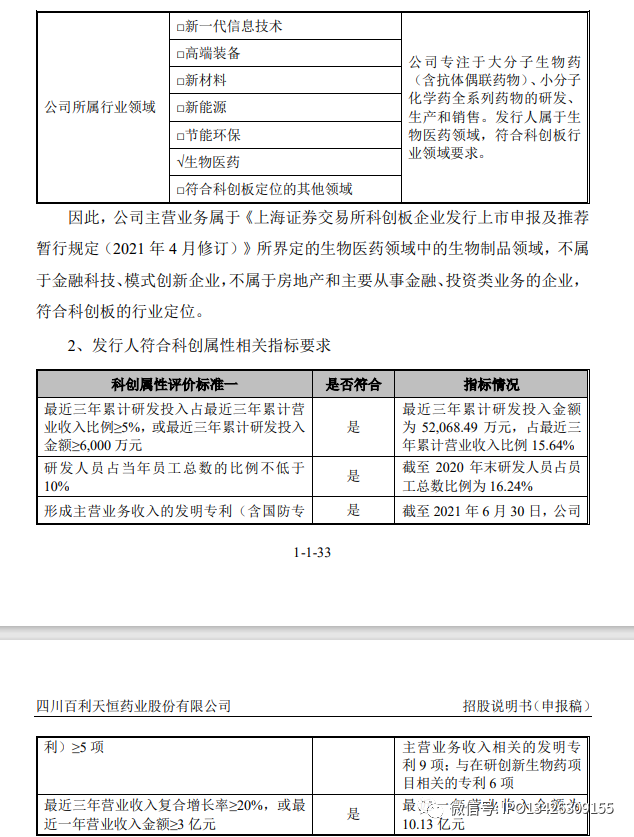
(二)发行人符合《上海证券交易所科创板企业发行上市申报及推荐暂行规定(2021 年 4 月修订)》和《科创属性评价指引(试行)》情况分析
1、发行人符合行业领域要求
发行人是一家集药品研发、生产与营销一体化的现代生物医药企业,拥有化药制剂与中成药制剂业务板块和创新生物药业务板块,具备包括小分子化学药、大分子生物药及抗体偶联药物(ADC 药物)的全系列药物研究开发生产能力;拥有中美两地研发中心(美国:Systimmune;中国:百利药业和多特生物等)、1 个大分子生物药及抗体偶联药物(ADC 药物)生产企业(多特生物)、2 个化药制剂生产企业(百利药业和国瑞药业)、1 个化学原料药生产企业(精西药业)、1 个化学中间体生产企业(海亚特科技)以及 2 个药品营销公司(百利天恒和拉萨新博);覆盖从中间体、原料药到制剂的上下游一体化能力及“研发—生产—营销”完整全生命周期商业化运营能力。
发行人具备乳状注射剂、大/小容量注射剂、冻干粉针剂、固体制剂等多种剂型的生产能力。依靠长期积累的技术、人才、品牌优势,公司自 2011 年开始布局创新生物药领域,深耕于肿瘤治疗领域,致力于研制具有完全自主知识产权和全球权益的、具有突破性疗效的创新生物药。报告期内公司形成主营业务收入的产品主要为化药制剂和中成药制剂,拥有多种疗效显著、临床认可度高的药品,治疗领域覆盖麻醉、肠外营养、抗感染、儿科等多个方向。
公司拥有两大业务板块,分别为化药制剂与中成药制剂业务板块和创新生物药业务板块,收入全部来自于化药制剂与中成药制剂业务板块,创新生物药均处于研发阶段,尚未产生营业收入。在化药制剂中,已通过一致性评价的产品有盐酸右美托咪定注射液和丙泊酚中/长链脂肪乳注射液,其报告期内分别实现42,631.47 万元、50,557.40 万元、39,625.16 万元和 11,410.48 万元销售收入,占主营业务收入比例分别为 38.46%、41.97%、39.19%和27.03%。其他未通过及无需进行一致性评价的产品,报告期内销售收入分别为 68,221.45 万元、69,893.10 万元、61,479.72 万元和 30,807.50 万元,占主营业务收入比例分别为 61.54%、58.03%、60.81%和72.97%。
研发投入较大导致持续亏损的风险
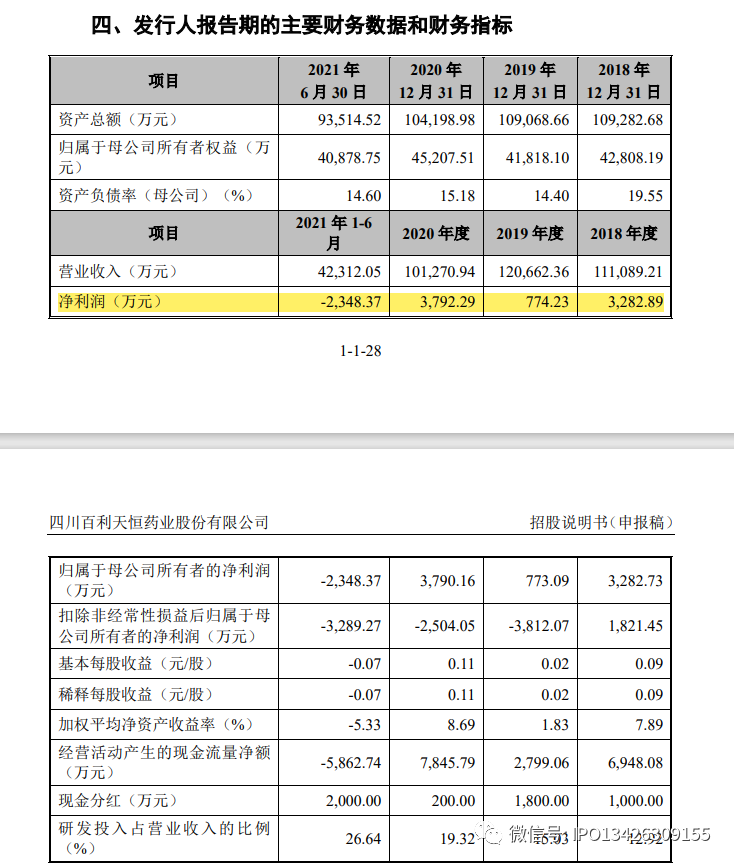
报告期内,公司实现净利润分别为3,282.89 万元、774.23 万元、3,792.29 万元和-2,348.37 万元,扣除非经常性损益后归属于母公司股东的净利润分别为1,821.45万元、-3,812.07 万元、-2,504.05 万元和-3,289.27 万元。2019 年、2020年和 2021 年 1-6 月,公司扣除非经常性损益后的净利润为负数,主要原因系公司在创新药和高端仿制药研发投入较大。报告期内,公司研发投入金额分别为14,357.54 万元、18,141.07 万元、19,569.88 万元和 11,271.13 万元。截至本招股说明书签署日,公司拥有 42 项在研项目,仍面临较大的研发投入。公司未来一定期间内亏损程度将取决于公司药品研发项目的数量及研发进度、与该等项目有关的成本、获批产品进行商业化生产的成本、公司产生收入的能力等方面。若未来公司在研创新药或者仿制药未获得监管部门批准、或上市推广效果不佳未获医生、患者、医院或其他方的认可,或仿制药未在国家药品集中采购中标,公司可能存在短期内持续亏损的风险。
公司控股股东和实际控制人
截至本招股说明书签署日,公司控股股东、实际控制人为朱义先生,持有公司 82.6016%的股份。
朱义先生,1963 年 12 月出生,中国国籍,无境外永久居留权,身份证号码为:5101021963********,四川大学无线电系本科,复旦大学生物系研究生以及四川大学管理学博士。现为公司董事长、总经理、首席科学官及核心技术人员。1987 年 9 月至 1990 年 12 月,于华西医科大学微生物与免疫学教研室任教;1991年 1 月至 1992 年 3 月,任成都生物医学工程中心四达生化厂厂长;1992 年 3 月至 2012 年 10 月,任新博科技董事长;1996 年 8 月至 2011 年 9 月,朱义先生成立百利药业并任董事长、总经理;2010 年 11 月至 2011 年 10 月,任天恒有限董事长、总经理;2011 年 11 月至今,任公司董事长、总经理;目前兼任公司首席科学官及核心技术人员,百利药业董事长,多特生物执行董事、经理,盘古资本执行董事,SystImmune 执行董事、总经理。
问题 20.关于前次 IPO 现场检查问题的整改
根据保荐工作报告,发行人曾于 2012 年 12 月 21 日申报创业板上市,2015年 4 月 3 日被抽中现场检查,经检查发现的财务问题包括:
(1)2013 年度销售费推广费预提不足导致部分销售费用跨期确认的问题;
(2)部分销售签收单未签署日期或者签收单未及时收回导致收入确认时点的问题;
(3)存在部分员工釆用个人账户或现金收款的问题。针对上述现场检查问题,发行人进行了整改。
请发行人说明:(1)报告期跨期费用的调整情况,是否就费用跨期的会计基础工作及内控制度进行规范,报告期仍存在费用跨期的问题是否表明报告期相关会计基础工作不规范或内控制度未被有效执行;(2)发行人关于签收单管理措施的整改时间及具体整改措施,整改后的措施是否健全并被有效执行;报告期是否存在因签收单管理导致的收入确认跨期的问题以及相应的财务调整情况;(3)个人卡情况及收付款情况以及相关交易实质的认定,是否已完整还原至申报报表中;报告期个人卡收付款的内控制度是否健全,是否能够合理保证公司运行效率、合法合规和财务报告的可靠性;个人卡账户收付款的整改时间及具体整改措施;(4)报告期现金收付款的具体情况;现金交易是否符合行业经营特点或经营模式;现金管理制度是否与业务模式匹配且执行有效;现金交易是否可验证,是否影响发行人内部控制有效性;现金交易相关收入确认及成本核算的原则与依据,是否存在体外循环或虚构业务的情形;发行人为减少现金交易釆取的改进措施及进展情况。
请申报会计师核查并发表明确核查意见。
【回复】
一、报告期跨期费用的调整情况,是否就费用跨期的会计基础工作及内控制度进行规范,报告期仍存在费用跨期的问题是否表明报告期相关会计基础工作不规范或内控制度未被有效执行
前次申报报告期内发行人存在部分期间费用跨期的问题,发行人已于前次申报期间内完成了整改并对相关费用科目进行了调整。截至本报告期初,发行人已按职能设置了财务总监、总账会计、出纳、税务会计、往来会计、成本会计等岗位,并对每一个会计岗位制定了岗位职责。财务部员工均专职在财务部工作,财务部相关人员均具备任职要求,能够胜任岗位工作,关键岗位均做到不相容岗位分离原则,确保了会计基础工作的规范。
发行人全面梳理并完善了与期间费用相关的内部控制制度,从内控制度上对期间费用的结算进行规范,确保期间费用计入恰当的会计期间,杜绝报告期前期存在的期间费用跨期现象;发行人引入了经验丰富的财务人员,并加强了对财务人员的培训,要求期间费用的审批、报销、入账环节需严格审核,确保期间费用的核算遵循权责发生制的要求。
本次申报报告期内发行人与期间费用相关的内部控制制度运行有效,不存在期间费用跨期的情况。
二、发行人关于签收单管理措施的整改时间及具体整改措施,整改后的措施是否健全并被有效执行;报告期是否存在因签收单管理导致的收入确认跨期的问题以及相应的财务调整情况

三、个人卡情况及收付款情况以及相关交易实质的认定,是否已完整还原至申报报表中;报告期个人卡收付款的内控制度是否健全,是否能够合理保证公司运行效率、合法合规和财务报告的可靠性;个人卡账户收付款的整改时间及具体整改措施
前次申报报告期内,公司存在将员工开设的银行账户作为公司现金进行管理、利用员工(业务员)开设的银行账户收取货款但未作为现金管理。针对上述情况,公司于前次申报期间完成了整改,并于 2013 年将所有相关个人账户注销并承诺不再利用员工账户进行货款收支。
本次申报报告期内,公司不存在使用个人卡账户的情况。
四、报告期现金收付款的具体情况;现金交易是否符合行业经营特点或经营模式;现金管理制度是否与业务模式匹配且执行有效;现金交易是否可验证,是否影响发行人内部控制有效性;现金交易相关收入确认及成本核算的原则与依据,是否存在体外循环或虚构业务的情形;发行人为减少现金交易釆取的改进措施及进展情况
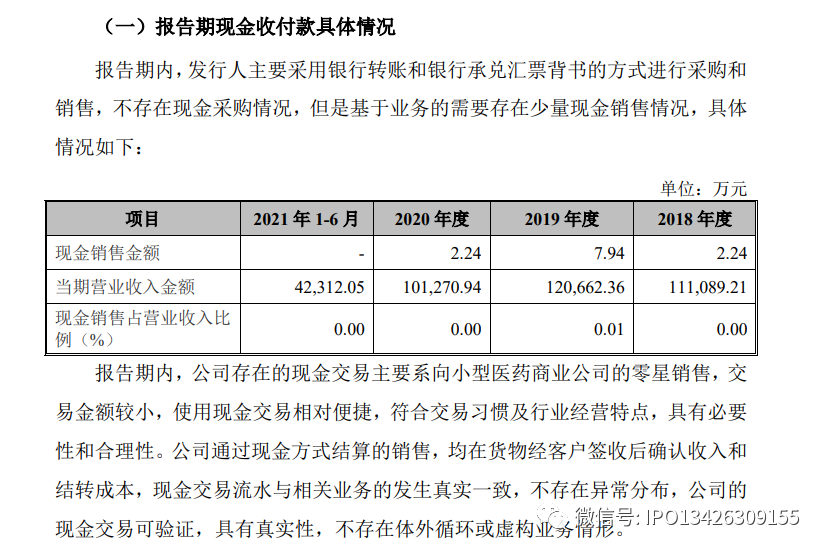
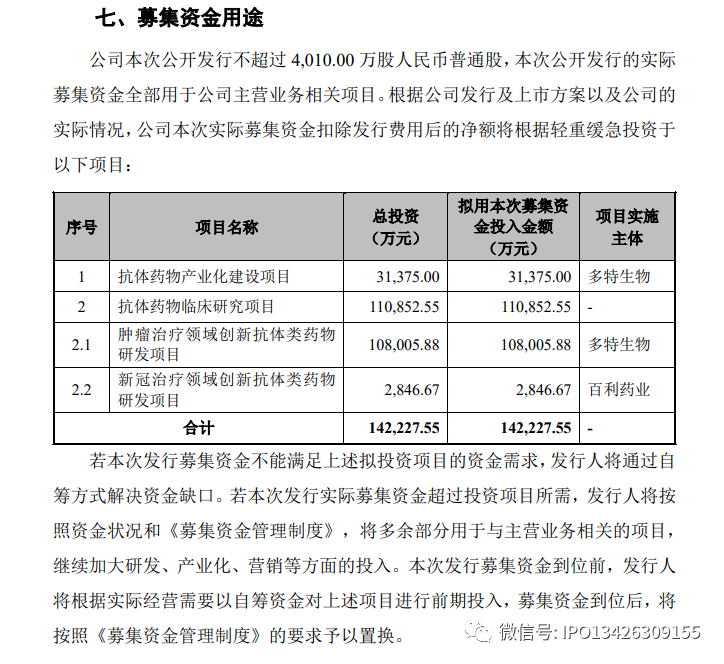
(二)发行人与现金相关的管理制度及减少现金交易釆取的改进情况
发行人制定了《资金管理业务流程控制制度》,对现金的使用范围及额度、现金的收付登记及审批权限、盘点与监督等做出了明确的规定,并得到了有效执行。上述制度的建立,有利于保证公司的资金安全,防范由于现金使用而导致的管理风险。
发行人严格执行与现金相关的内控管理制度,对业务人员进行相关培训,提升合规意识,严格控制现金交易的发生,同时要求零星客户尽量以银行转账的方式进行货款结算以减少现金交易。报告期内,公司现金收款金额较小,表明报告期内发行人对现金交易的规范效果显著,相关内控程序设计合理、运行有效。
五、申报会计师核查并发表明确意见
(一)核查程序
1、了解、评价和测试公司与期间费用相关的内部控制的设计合理性和运行有效性;
2、获取期间费用明细表,了解各项明细费用性质和变动的原因;
3、获取金额重大的费用合同,审阅合同相关条款,判断相关费用是否已经完整计提,检查了相关发票、银行流水支付凭证,判断相关费用的准确性;
4、对公司期间费用进行截止性测试,抽查财务报告截止日前后的费用凭证,以确定期间费用被记录在正确的会计期间;
5、了解、评价和测试公司签收单管理相关的内部控制制度建立和运行有效性;
6、检查公司对主要客户发货的签收单、增值税发票、银行回单、银行承兑汇票等原始回款单据;
7、对公司销售收入执行截止性测试,检查收入是否确认在恰当的会计期间,是否记录完整,是否存在跨期;
8、了解、评价和测试发行人个人卡账户及现金管理相关的内部控制制度建立和运行有效性;
9、查阅库存现金日记账、收入明细账、采购明细账,核查现金交易的金额及比例;
10、获取控股股东、实际控制人、发行人董事、监事、高管及关键岗位人员等开立或控制的银行账户资金流水,核查是否存在公司使用个人卡的情况,是否与公司供应商、客户有资金往来,是否存在为公司代垫成本、费用及虚增收入等体外循环情况。
(二)核查意见
经核查,申报会计师认为
1、报告期内,发行人与期间费用相关的内部控制的设计合理、运行有效,不存在期间费用跨期的情况;
2、报告期内,发行人签收单管理措施设计健全、运行有效,不存在因签收单管理导致收入确认跨期的情况;
3、报告期内,发行人不存在使用个人卡账户的情况,与个人卡账户相关的内部控制设计合理、运行有效,能够合理保证公司运行效率、合法合规和财务报告的可靠性;
4、报告期内,发行人现金交易与业务情况相符,具有合理性;发行人现金交易具有可验证性,且不影响发行人内部控制有效性;现金交易金额较低,且现金交易比例及其变动情况整体处于合理范围内;现金管理制度与业务模式匹配且执行有效,且发行人已为减少现金交易采取了改进措施并且进展情况良好。
来源:企业上市编委整理